Химия. ОВР. Метод полуреакций VS метод электронного баланса
Здесь мы еще раз вернемся к теме окислительно-восстановительных реакций и выясним, каким же методом предпочтительней расставлять коэффициенты в уравнениях таких реакций. Для этого выполним расстановку коэффициентов в одной и той же реакциями двумя методами - методом полуреакций и методом электронного баланса.
Возьмем вот такую реакцию
![]()
Метод полуреакций
Первым делом разбиваем все растворимые молекулы на ионы и расставляем степени окисления каждой из них. Получается так
![]()
Смотрим на данную запись и определяем, какие ионы меняют степень окисления в ходе реакции. Видно, что это ионы, содержащие Mn и S. Они и будут входить в наши полуреакции. Начнем с марганца.
![]()
Сначала уравниваем количество атомов марганца. Оно у нас равно, так что оставляем как есть. Далее смотрим на исходную реакцию, и видим, что среда реакции - нейтральная (вода в левой части, гидроксо-группа в правой). Значит, нам нужно уравнять с помощью воды и гидроксо-групп количество атомов кислорода и водорода в полуреакции. Слева добавляем воду, справа - гидроксо-группу, как в основной реакции
![]()
Слева 5 атомов кислорода и 2 атома водорода. Справа - 3 атома кислорода и 1 водорода. Можно уравнять их простым подбором. Можно составить несложную систему уравнений. Перед ионами с марганцем никаких коэффициентов ставить нельзя, так как мы их уже уравняли. Пусть перед водой коэффициент x, а перед гидроксо-группой - y. Получим систему уравнений
для кислорода 4+x*1=2+y*1
для водорода x*2 = y*1
Из этой системы легко найти y=2x=4
Получаем
![]()
Последний штрих - с помощью электронов (заряд которых естественно равен -1) уравниваем заряды в правой и левой частях. Заряд слева равен -2, заряд справа -4. Значит, надо добавить слева 2 электрона. Итак
![]()
Поскольку ион в данной полуреакции забирает электроны (+2е в левой части), значит, это полуреакция восстановления, а сам ион является окислителем.
Полуреакция с участие атомов серы.
![]()
Алгоритм тот же. Уравниваем атомы серы (выполнено), уравниваем кислород и водород с помощью воды и гидроксо-группы (не требуется, так как в ион нет ни кислорода, ни водорода), уравниваем заряды с помощью электронов.
![]()
Поскольку ион в данной полуреакции теряет электроны (-2е в левой части), значит, это полуреакция окисления, а сам ион является восстановителем.
Записываем рядом обе полуреакции. Выравниваем количество электронов в них, умножая полуреакцию окисления на количество электронов в полуреакции восстановления и наоборот. Так как у нас количества электронов оказались равны, после сокращения получаем, что обе полуреакции нужно умножить на 1.
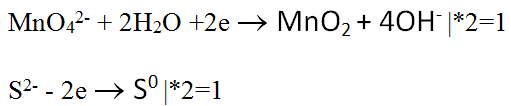
Записываем ионно-молекулярное уравнение с учетом полученной информации. Мы пропишем все единицы, но вообще, можно их не писать, это же единицы.
![]()
После упрощения
![]()
Теперь возвращаемся к молекулярной записи уравнения.
![]()
Уравниваем атомы калия = слева 4, справа 1, значит, справа должно быть 4 атома.
![]()
И окончательно
![]()
Проверку обычно делают по атомам кислорода. Слева 4+2=6. Справа 2+4=6. Все верно.
Метод электронного баланса
Расставляем степени окисления всех атомов в реакции
![]()
Выбираем те атомы, которые в ходе реакции поменяют степень окисления. Это атом марганца
![]()
и атом серы
![]()
Просто электронами с зарядом -1 выравниваем заряды атомов. Марганец забирает 2 электрона, следовательно, является окислителем, сера отдает 2 электрона, следовательно, является восстановителем. Каждое уравнение умножаем на 2 (после сокращения - на 1)
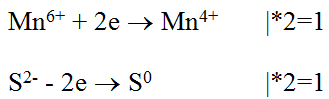
Получаем
![]()
Теперь, не трогая те молекулы, где коэффициент уже стоит, уравниваем остальное. Слева 4 атома калия, справа 1, значит, калий в правой части умножаем на 4
![]()
Слева 2 атома водорода, справа 4, значит, водород в левой части умножаем на 2.
![]()
Все коэффициенты расставлены, проверяем по кислороду. Слева 4+2=6. Справа 2+4=6. Все верно.
Окончательно,
![]()
Результаты расстановки коэффициентов двумя методами совпали.
Каким методом лучше пользоваться? Все зависит от ваших предпочтений и навыков. На наш взгляд метод электронного баланса проще и короче, поэтому, когда нужно быстро, "на коленке" расставить коэффициенты, мы используем его.
Ну, а для максимальной скорости и для самоконтроля можно использовать онлайн-ресурсы. Там результат будет получен мгновенно, правда, без объяснений

Надеемся, что материал данной статьи был полезен для вас.
Всегда ваша, Botva-Project
Контакты и реквизиты
|
|
Ботва Вконтакте: |
|
|
Кошелек Yandex-деньги: |
41001685155788 |
|
|
|
Группа Вконтакте: |
|
|
QIWI-кошелек: |
9099441606 |
|
|
Электронная почта: |
botva-project@yandex.ru |
|
|
Кошелек Webmoney: |
R517790048459 |
